7 Extração
A extração de DNA é um processo fundamental em genética molecular que consiste em separar o material genético de uma célula ou tecido para que possa ser estudado e manipulado. Existem várias técnicas de extração de DNA, mas todas elas envolvem a lise da célula para liberar o DNA e a purificação do DNA para remover contaminantes. Para que seja possível conseguir DNA de boa qualidade, existem protocolos que foram testados, adaptados e otimizados para cada grupo estudado no laboratório.
A primeira etapa da extração de DNA é a lise da célula, que pode ser feita de várias maneiras, como maceração mecânica, lise com detergentes ou lise com enzimas (como a Proteinase K). Na maioria dos protocolos utilizados para extração de DNA no Nupgen os três métodos de lise celular são combinados, ou seja, é primeiramente realizada a maceração mecânica, adicionado tampão que contém detergentes que atuam nos lipídios das membranas promovendo o seu rompimento e posteriormente a enzima Proteinase K também é adicionada.
Após a lise das células, o DNA precisa ser separado dos restos celulares e das proteínas. Dessa maneira, o DNA é purificado por meio de precipitação com etanol ou cloreto de sódio, ou por meio de centrifugação em colunas. Uma vez que o DNA é purificado, ele pode ser utilizado em várias aplicações, como sequenciamento de DNA, clonagem, análise de expressão gênica e muito mais. No entanto, é importante lembrar que o DNA é um material frágil e pode ser danificado facilmente, portanto, é importante tomar cuidado durante todo o processo de extração e manipulação.
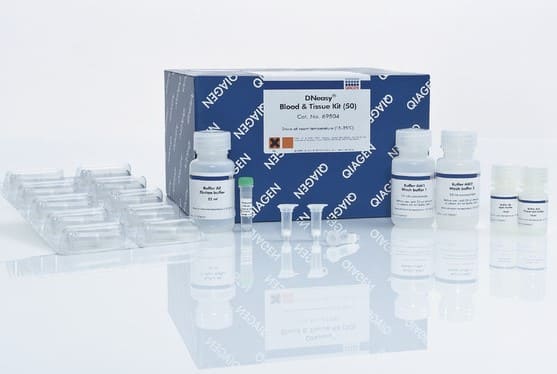
Atualmente no Nupgen são utilizados dois kits de extração diferentes: Wizard® Genomic DNA Purification Kit (Promega®) e DNeasy® Blood and Tissue Kit (QIAGEN®). A escolha do kit irá depender do organismo a ser estudado, por exemplo, para peixes, gastrópodes e macrófitas recomenda-se a utilização do kit da Promega e para organismos menores, como parasitas, o kit em colunas da QIAGEN é o mais ideal.
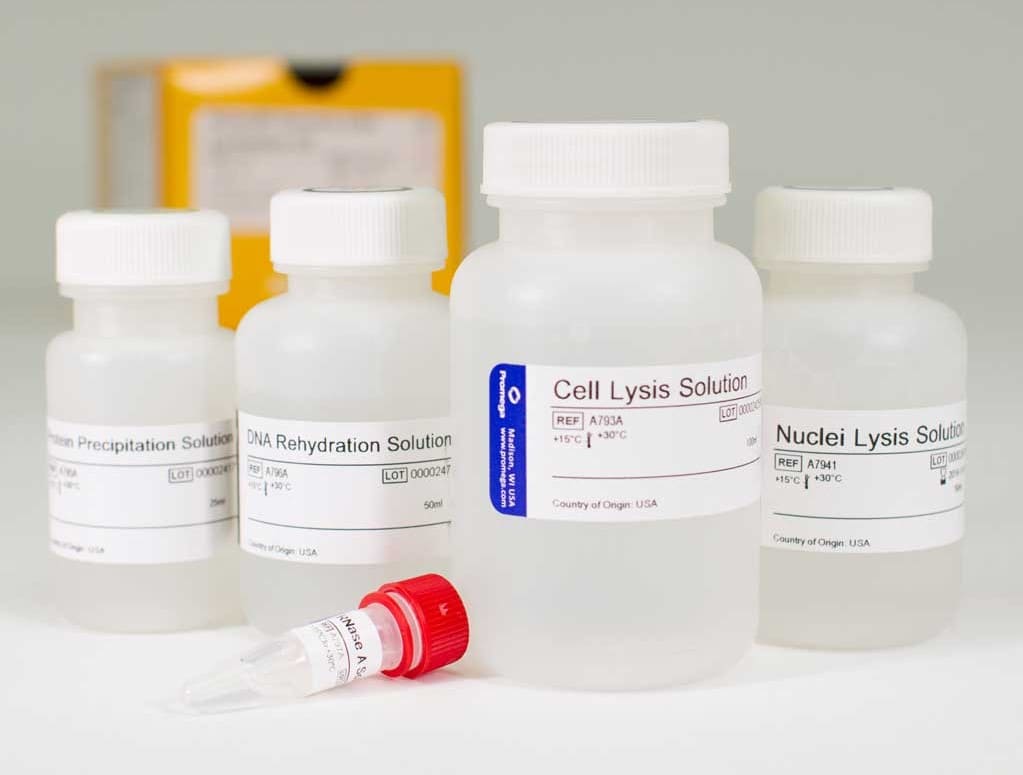
7.1 Protocolo de Extração de DNA - Promega Peixes
Com pinça e bisturi, fracionar aproximadamente 20 mg de músculo.
Adicionar 400 μL de Nuclei Lysis Solution.
Incubar por 30 minutos a 55º C.
Adicionar 10 μL de Proteinase K 20 mg/ml.
Incubar a 55º C overnight ou de 2-3 horas até ficar homogêneo.
Adicionar 2 μL de RNAse Kit Solution e mexer a amostra por inversão.
Incubar 30 minutos a 37º C.
Deixar em temperatura ambiente por 5 minutos.
Adicionar 200 μL de Protein Precipitation Solution e agitar por 20 segundos.
Deixar no gelo por 5 minutos.
Centrifugar por 10 minutos a 12.000 rpm.
Remover o sobrenadante transferindo para um tubo novo – descartar o pellet.
Adicionar 600 μL de isopropanol e agitar por inversão.
Centrifugar por 2 minutos a 12.000 rpm – descartar o sobrenadante.
Adicionar 600 μL de etanol 70% a temperatura ambiente.
Centrifugar por 2 minutos a 12.000 rpm – descartar sobrenadante.
Deixar secar – pode ser na estufa.
Ressuspender em 30 μL de DNA Rehidration Solution. Deixar por 1 hora no banho a 65º C ou overnight a 4º C.
7.2 Protocolo de Extração de DNA - Promega Caramujos
Fracionar o tecido (0,5-1 cm) e adicionar em um tubo de 1,5 ml.
Adicionar 500 μl de Nuclei Lysis Solution.
Macerar o tecido com um pistilo.
Adicionar 17,5 μl de Proteinase K 20 mg/ml.
Homogeneizar com vórtex por 10 segundos.
Incubar a 55º C overnight OU incubar a 55º C por 3 horas, homogeneizando com vórtex a cada hora.
Adicionar 3 μl de RNase Solution à solução e misturar por inversão do tubo 2-5 vezes.
Incubar a 37º C por 30 minutos. Deixar as amostras esfriarem a temperatura ambiente por 5 minutos antes da próxima etapa.
Adicionar 200 μl de Protein Precipitation Solution e homogeneizar com o vórtex vigorosamente por 20 segundos.
Colocar as amostras no gelo por 5 minutos.
Centrifugar a 12.000 rpm por 4 minutos. Nesta etapa pode ser formado um pellet no fundo do tubo.
Remover cuidadosamente o sobrenadante contendo o DNA (não retirar o pellet) e transferir para um novo tubo de 1,5 ml que já contenha 600 μl de isopropanol (temperatura ambiente).
Misturar cuidadosamente a solução por inversão até os “fios” de DNA formarem uma massa visível.
Centrifugar a 12.000 rpm por 1 minuto. O DNA ficará no fundo do tubo e pode ficar visível como um pequeno pellet branco. Descartar cuidadosamente o sobrenadante.
Adicionar 600 μl de etanol 70% (temperatura ambiente) e misturar cuidadosamente a solução por inversão.
Centrifugar a 12.000 rpm por 1 minuto.
Retirar o etanol cuidadosamente com uma pipeta sem retirar o pellet.
Inverter os tubos em papel e deixar secar por 10-15 minutos.
Adicionar 30 μL de DNA Rehydration Solution e reidratar o DNA incubando a 65º C por 1 hora. Periodicamente misturar a solução com cuidado OU incubar a 4º C overnight.
Armazenar o DNA extraído a 2-8º C.
7.3 Protocolo de Extração de DNA - Promega Macrófitas
Nos tubos de 1,5 mL escrever o código da amostra correspondente, colocar o código no tubo Falcon também – Passo anterior ao início da extração.
Com uma pinça, pegar a folha da macrófita e colocar no cadinho (caso a folha seja muito grande, pode cortar ela para caber inteira); despejar nitrogênio líquido no cadinho e com o auxílio do pistilo macerar a amostra (usar mais de uma vez o nitrogênio para macerar bem).
Ao terminar a maceração, transferir um pouco do pó formado para o tubo de 1,5 mL correspondente (pode usar a pazinha de plástico para facilitar).
Adicionar 600 μL de Nuclei Lysis Solution (logo após macerar).
Deixar no banho-maria por 15 minutos a 65°C.
Adicionar 3 μL de RNAse.
Inverter o tubo 5x.
Colocar no banho-maria por 15 minutos a 37°C.
Deixar por 5 minutos em temperatura ambiente.
Adicionar 200 μL de Protein Precipitation Solution.
Homogeneizar no vórtex.
Centrifugar por 3 minutos a 16.000 g ou 13.000 rpm.
Retirar o sobrenadante e transferir para um novo tubo de 1,5 mL. Descartar o precipitado.
Adicionar 600 μL de isopropanol ao sobrenadante.
Inverter o tubo 5x.
Centrifugar por 1 minuto a 16.000 g ou 13.000 rpm.
Descartar o sobrenadante.
Adicionar 600 μL de etanol 70%.
Inverter o tubo 5x.
Centrifugar por 1 minuto a 16.000 g ou 13.000 rpm.
Descartar o sobrenadante.
Deixar o tubo secar por 15 minutos na estufa ou até não ter mais gotas de álcool.
Adicionar 30/50 μL de DNA Rehydration Solution.
7.4 Protocolo de Extração de DNA com Colunas - QIAGEN DNEasy Blood and Tissue - Parasitos
Existem 2 kits de coluna diferentes, o QIAGEN DNEasy Blood and Tissue e o QIAGEN QIAamp DNA Blood Mini. Preste atenção em qual será o kit utilizado.
Deixar o mínimo possível de líquido na amostra antes de começar.
Adicionar 180 μL de Buffer ATL.
Adicionar 20 μL de proteinase K. Homogeneizar com vórtex e incubar a 56º C até completa lise celular (30min - 2h). Homogeneizar com vórtex ocasionalmente durante a incubação.
Homogeneizar com vórtex por 15 segundos.
Adicionar 200 μL de Buffer AL. Homogeneizar bem com vórtex.
Adicionar 200 μL de etanol (96-100%). Homogeneizar bem com vórtex.
Pipetar a mistura em uma coluna de centrifugação DNeasy Mini colocada em um tubo de coleta. Centrifugar a 8.000 rpm (≥6.000 x g) por 1 minuto. Descartar o líquido filtrado e o tubo de coleta.
Colocar a coluna em um novo tubo de coleta do kit. Adicionar 500 μL de Buffer AW1. Centrifugar por 1 minuto a 8.000 rpm. Descartar o líquido filtrado e o tubo de coleta.
Colocar a coluna em um novo tubo de coleta do kit. Adicionar 500 μL de Buffer AW2. Centrifugar por 3 minutos a 14.000 rpm (≥20.000 x g). Descartar o líquido filtrado e o tubo de coleta.
Transferir a coluna para um eppendorf de 1,5 mL.
Adicionar 50 μL de Buffer AE no centro da membrana da coluna para a eluição do DNA. Incubar por 1 minuto a temperatura ambiente (15-25º C). Centrifugar por 1 minuto a 8.000 rpm.
Descartar a coluna e guardar o DNA extraído.
7.5 Protocolo de Extração de DNA com Colunas - QIAGEN QIAamp DNA Blood Mini - Parasitos
Existem 2 kits de coluna diferentes, o QIAGEN DNEasy Blood and Tissue e QIAGEN QIAamp DNA Blood Mini. Preste atenção em qual será o kit utilizado.
Deixar o mínimo possível de líquido na amostra antes de começar.
Adicionar 200 µL de Buffer AL.
Adicionar 20 µL de proteinase K. Misturar com vórtex e incubar a 56ºC até completa lise celular (30min - 2h). Misturar com vórtex ocasionalmente durante a incubação.
Misturar com vórtex por 15 segundos.
Adicionar 200 µL de etanol (96-100%). Misturar bem com vórtex.
Pipetar a mistura em uma coluna de centrifugação DNeasy Mini colocada em um tubo de coleta. Centrifugar a 8000 rpm (≥6000 x g) por 1 minuto. Descartar o líquido filtrado e o tubo de coleta.
Colocar a coluna em um novo tubo de coleta do kit. Adicionar 500 µL de Buffer AW1. Centrifugar por 1 minuto a 8000 rpm. Descartar o líquido filtrado e o tubo de coleta.
Colocar a coluna em um novo tubo de coleta do kit. Adicionar 500 µL de Buffer AW2. Centrifugar por 3 minutos a 14.000 rpm (≥20.000 x g). Descartar o líquido filtrado e o tubo de coleta.
Transferir a coluna para um eppendorf de 1,5 mL.
Adicionar 50 µL de Buffer AE no centro da membrana da coluna para a eluição do DNA. Incubar por 1 minuto a temperatura ambiente (15-25ºC). Centrifugar por 1 minuto a 8000 rpm.
Descartar a coluna e guardar o DNA extraído.